Jesteśmy tu po to, byście mogli tworzyć swoje biznesy ze spokojną głową.
Chemiczna historia świec cz.1
Jest to pierwszy post z serii, w którym skupimy się bardziej na chemii i fizyce spalania świec. W serii opowiemy dokładniej jak spalanie świec wygląda od strony naukowej i cofniemy się do historii. W tym poście skupimy się na tym, jaką rolę spełnił w kwestii świec Michael Faraday, znakomity fizyk XVIII i XIX wieku.
ŚWIECE SOJOWECHEMICZNA HISTORIA ŚWIECCHEMIA, FIZYKA, NAUKA
10/19/20246 min czytać


Ten wpis to początek naszej serii CHEMIA PŁOMIENIA, dedykowanej Twórcom świec poświęconej tematom, które nam są szczególnie bliskie, czyli nauce.
Na codzień opracowujemy dla Twórców świec dokumentację chemiczną, która pozwala w legalny i bezpieczny sposób wprowadzać takie produkty na rynek, ale jesteśmy również z wykształcenia technologami chemicznymi i przede wszystkim... uważamy, że naukowa strona świec jest fascynująca!
Przeprowadziamy Was trochę przez ten świat, damy Wam trochę wskazówek, rad, postaramy się napisać je możliwie najprostszym językiem.
Dlaczego warto znać chemię i fizykę świec? Bardzo często zgłaszacie się do nas z pytaniami technicznymi, na przykład: czy świeca musi leżakować 14 dni i skąd się to wzięło, czy możemy powiedzieć, że świece sojowe są w pełni zdrowe i bezpieczne, w jakich temperaturach najlepiej łączy się wosk z olejkiem zapachowym... Im większe mamy zrozumienie na temat podstaw świec, tym łatwiej będzie nam zrozumieć i odpowiedzieć na tego typu zagadnienia.
Część serii będzie na naszym blogu, część na naszych mediach społecznościowych, a część w newsletterze, dlatego już teraz zachęcam Was do zapisania się i obserwowania!
A teraz do rzeczy... na początek, przejdziemy do historii. Dlaczego od niej zaczynamy? Myślę, że warto wiedzieć jakich czasów sięgają informacje, które nadal są opracowywane przez naukowców i przede wszystkim, komu tę wiedzę zawdzięczamy.
Koniec wstępu, odpalamy świecę, żeby zrobić lepszą atmosferę i przechodzimy do dalszej części.
WSTĘP
Trochę historii


Czy zastanawialiście się kiedykolwiek nad nauką, która kryje się pod, pozornie, prostym płomieniem?
Michael Faraday, genialny fizyk, który znacznie przyczynił się do zrozumienia przede wszystkim zjawisk elektrycznych, ale nie tylko! W swoich słynnych wykładach „Chemical History of a Candle” odkrył tajemnice tego zjawiska, pokazując, że nawet coś tak pozornie prostego, jak świeca, może być skomplikowanym i fascynującym tematem badań naukowych.
W 1860 roku Michael Faraday wygłosił swój słynny cykl wykładów na temat historii chemicznej świecy, demonstrując dziesiątki naukowych zasad poprzez swoje staranne obserwacje płonącej świecy.
Pod koniec lat 90. NASA wyniosła badania nad świecami na inny poziom, przeprowadzając eksperymenty z wahadłowcem kosmicznym, aby dowiedzieć się więcej o zachowaniu płomieni świec w mikrograwitacji.
Naukowcy na uniwersytetach i w laboratoriach badawczych na całym świecie nadal przeprowadzają eksperymenty ze świecami, aby dowiedzieć się więcej o płomieniach świec, emisjach i spalaniu.
I oczywiście tysiące uczniów każdego roku bada zasady ciepła, światła i spalania poprzez szkolne projekty naukowe dotyczące świec. My również byliśmy takimi uczniami, ponieważ spalanie, na studiach chemicznych to bardzo obszerny temat, wybiegający oczywiście znacznie dalej niż sama tematyka świec.
Źródło grafiki: https://pl.wikipedia.org/wiki/Michael_Faraday
Wykłady prowadzone przez Faradaya cieszyły się ogromnym powodzeniem i były dedykowane tak zwanym "młodym dorosłym", czyli osobami z przedział wiekowego 15-20 lat. Seria wykładów została wygłoszona 3 razy i na ostatnim z nich (w 1861 roku) uczestniczyło w nich aż 700 osób, co jak na tamte lata i możliwości przekazywania informacji uważamy za wysoki wynik.
Cytując Faradaya: „Nie ma lepszych, bardziej otwartych drzwi, przez które można wejść do nauki niż rozważając zjawiska fizyczne świecy”. Pokazuje to, jak bardzo fascynującym może być świat nauki, gdy patrzymy na niego przez pryzmat świec.
Faraday zauważa, że świeca pobiera tlen z powietrza, łączy go z węglem w wosku świecy, a te tworzą dwutlenek węgla i wodę. Ludzie wywołują tę samą reakcję chemiczną, gdy oddychają: tlen wdychany z powietrzem łączy się z otoczeniem zawierającym węgiel, wytwarzając dwutlenek węgla i wodę, które są następnie wydychane. Ta analogia spalania świecy do ludzkiego oddychania podkreśla jeden z wielkich tematów Faradaya: w jaki sposób głębokie zrozumienie podstawowych nauk łączy zjawiska w świecie fizycznym. Ponadto Faraday omawia nasze powiązania z królestwem roślin: podczas gdy ludzie pobierają tlen i uwalniają dwutlenek węgla, rośliny pobierają dwutlenek węgla i uwalniają tlen; to znaczy „co jest chorobą dla jednych, jest zdrowiem dla drugich”.
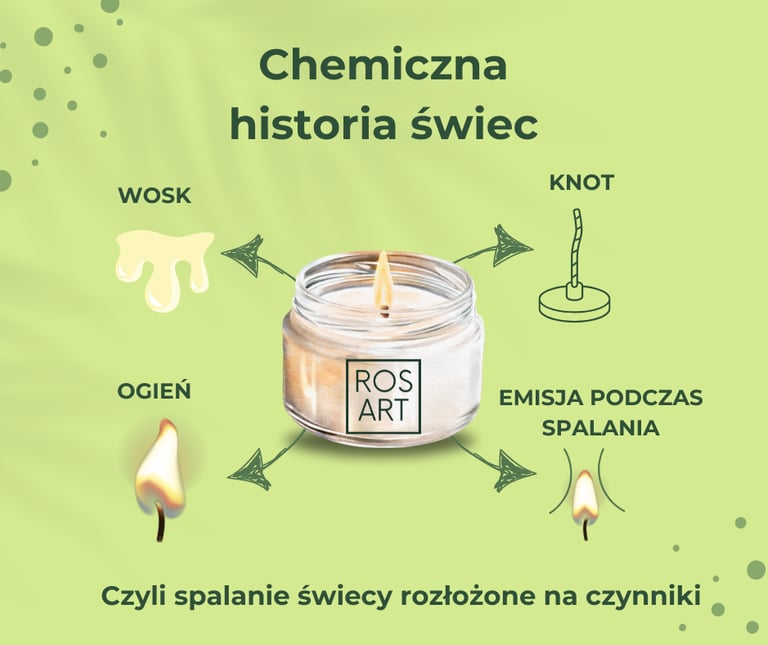
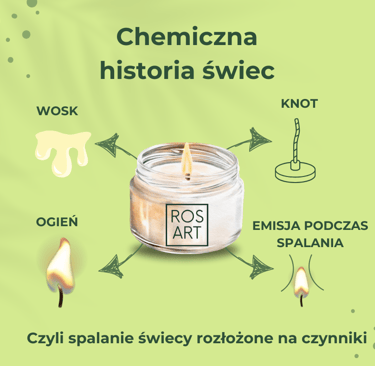
Faraday zaczął od najprostszych pytań: „Jak świeca pali się i dlaczego?” Jego podejście do nauki polegało na obserwacji i zadawaniu pytań o podstawowe, codzienne zjawiska. Wyjaśnił, że płomień świecy to więcej niż tylko ogień. W rzeczywistości jest to złożona reakcja chemiczna, w której zachodzi przemiana ciał stałych w gazy, a energia wytworzona przez tę reakcję emituje światło i ciepło.
Zaczniemy od szybkiego przeglądu składowych świecy.
Kiedy świeca jest zapalana po raz pierwszy, płomień pochłania knot, aż osiągnie punkt tuż nad woskiem. Ciepło z płomienia topi wosk poprzez promieniowanie przez powietrze i przewodzenie przez knot. Pali się tylko czubek knota. Ten płynny wosk wspina się po knotach do płomienia poprzez działanie kapilarne, gdzie stopiony wosk odparowuje. Następnie płomień spala tę parę tlenem dostarczanym przez otaczające powietrze. Ta reakcja uwalnia gazy — głównie dwutlenek węgla i parę wodną — oraz ciepło. Uwolnione ciepło topi więcej wosku, który ponownie wspina się po knotach i w ten sposób podtrzymuje płomień świecy. Świeca wykonuje zatem jednocześnie dwie czynności: jej płomień spala odparowany wosk i dostarcza wosk do płomienia, aby go podtrzymać.
1. Knot – serce świecy
Na początku Faraday skupił się na knocie – cieniutkim sznurku, który jest sercem każdej świecy. To knot sprawia, że świeca pali się równomiernie. Jak to działa? Knot pochłania stopiony wosk i działa jak „kanalik”, który transportuje ten wosk do wyższych temperatur na czubku knota. Dzięki kapilarności wosk wędruje w górę i staje się paliwem dla płomienia.
Przypomnij sobie teraz, czy tworząc świecę i dając do niej duże ilości stałego barwnika lub miki zdarzało Ci się, że, jak to mówimy, zapchał Ci się knot. A może odwiedzając grupy tematyczne lub będąc na szkoleniach ktoś powiedział Ci "dodatek miki w świecy zapycha knot i zaburza spalanie". Jeszcze nie spotkaliśmy się z wytłumaczeniem dlaczego tak się dzieje, a odpowiedzią są właśnie działania kapilarne! Bardzo ogólnikowo mówiąc, tylko żeby przełożyć to na łatwiejszy język, podczas spalania wosk wraz ze wspomnianymi dodatkami wspina się po knocie w kierunku ognia. Spalanie wosku przebiega w inny sposób niż dodatków. Czasy spalania są również inne. Dodatki takie jak mika w wyniku tego zjawiska nagromadzają się na powierzchni knota przy źródle ognia.
Kilka razy widzieliśmy jak poszukiwaliście innej miki, bo któraś zapychała Wam knot - jak widać, nie tędy droga.
2. Wosk – paliwo dla płomienia
Faraday zauważył, że płonąca świeca nie spala się bezpośrednio – wosk topi się, paruje, a dopiero pary wosku ulegają zapłonowi. Gdy knot się nagrzewa, wosk przechodzi w stan ciekły, a następnie w gazowy. To te opary wosku, które są bardzo łatwopalne, podtrzymują płomień, a nie sam wosk w postaci stałej. Zatem płomień świecy to efekt skomplikowanego procesu, w którym wosk przekształca się w gaz, a ten gaz się spala.
3. Tlen – niewidzialny „partner” płomienia
Oczywiście płomień świecy nie istniałby bez powietrza. Faraday zwrócił uwagę, że tlen jest kluczowym elementem reakcji spalania. Gdyby odciąć dopływ tlenu do płomienia, świeca zgaśnie. Tlen reaguje z węglem i wodorem zawartymi w wosku, tworząc dwutlenek węgla i wodę, a także uwalniając energię w postaci światła i ciepła. Płomień dokładnie będziemy jeszcze analizować - jego kolor oraz reakcje, jakie towarzyszą spalaniu.
4. Reakcja spalania – chemia w akcji
W trakcie spalania świecy dochodzi do reakcji chemicznej – utleniania węgla i wodoru z wosku. Ta reakcja jest nie tylko odpowiedzialna za płomień, ale również za wydzielanie produktów spalania, takich jak para wodna i dwutlenek węgla. Faraday zwrócił uwagę, że produkty te są normalnie niewidoczne, ale można je zobaczyć, przeprowadzając proste eksperymenty, np. nad płomieniem świecy zawieszając szklaną płytkę, która zaparuje od pary wodnej.
Płomień spala odparowany wosk tlenem dostarczanym przez otaczające powietrze. Ta reakcja uwalnia gazy — głównie dwutlenek węgla (CO2) i parę wodną (H2O)— oraz ciepło. Dwutlenek węgla powstaje z węgla (C) w wosku świecy i tlenu (O) w powietrzu, a woda powstaje z wodoru (H) w wosku i tlenu (O) w powietrzu.
Wpis powstał na podstawie: The Chemical History of a Candle, Michael Faraday's
Koniecznie dajcie nam znać, jeśli takie materiały są dla Was przydatne i mamy tworzyć ich więcej. Będzie nam miło jeśli nas zaobserwujecie i udostępnicie nasze materiały!
A jeśli potrzebujecie wsparcia w kwestiach dokumentacji i legalnej sprzedaży świec, zapraszamy do kontaktu.


Kontakt
Dowiaduj się jako pierwsza/y o promocjach, realizacjach, projektach. Zapisz się do newslettera.
